人工肝臓
1.肝臓の機能と代替のための多様なアプローチ
肝臓は人体の化学工場とも呼ばれるように,小腸から取り入れた栄養素を全身の細胞が使用する形へと変換することに加え,アンモニア等や乳酸といった老廃物の分解,アルブミンや血液凝固因子といったタンパク質の合成,外部から取り入れた薬物などの解毒といった多様な機能―判明しているだけで500種類以上の機能―を持っています.これらの機能を担っている肝細胞が,何らかの原因で障害を受け機能を維持できなくなり,様々な肝疾患に結びついてしまいます.肝臓は本来,旺盛な再生能力を持っているのですが,重篤な肝障害時からの再生による回復は簡単ではありません.
肝機能を代替するケースとそのアプローチは実に多様です(図1).アジア諸国では肝炎ウィルスの感染率が高いため,それに由来する急性肝炎の救命がまずは重視されました.以前から,血漿交換や血液浄化といった物理化学的な操作が治療に用いられてきています.しかし,より広範な機能代替や生き残った患者肝の再生促進を目指し,肝臓の細胞利用する生物学的(バイオ)人工肝の研究が盛んとなりました.その後,抗ウィルス薬の長足の進歩によって,治療対象はウィルス性肝炎から生活習慣を始めとする様々な原因による慢性肝炎へ移行しています.最近では,多様な肝機能の長期代替を目指し,生体組織工学を利用した再構築型の肝組織の埋込/肝再生医療といった永続的な治療へと研究の焦点が変わってきています.
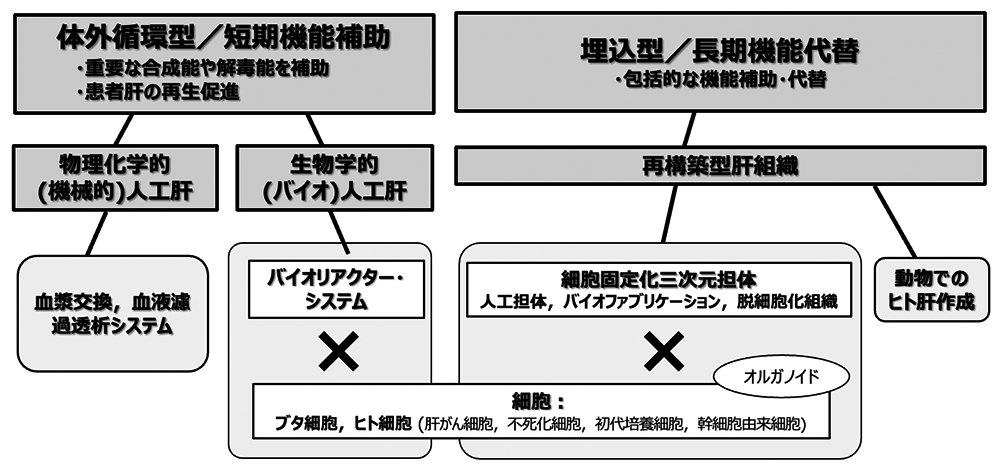
短期から長期,物理化学的システムからバイオ人工肝,再構築型組織まで.
2.物理化学的な体外循環型人工肝臓
急性肝不全時に,肝性昏睡からの覚醒を主な目的とし,アンモニアや炎症性物質を血漿濾過透析にて除去すると共に,不足する血液凝固因子等のタンパク質を血漿交換にて供給します.我が国においてはすでに治療として定着しており,良好な救命率が得られています.一方,亜急性型の救命率は低いままで,これらの物理化学的人工肝では,患者肝の再生の促進が不十分であることが一因と考えられます1).この場合には,最終的には肝移植を行わざるを得ませんが,わが国では圧倒的なドナー不足です.
3.細胞を利用した体外循環型人工肝臓
物理化学的人工肝の限界の克服を目指し,肝細胞を利用する生物学的(バイオ)人工肝の開発が盛んに行われてきました.このためには,細胞とバイオリアクターからなる適切な体外循環システムを組む必要があります(図1).肝臓は4分の3を切り取っても約2週間で元の大きさに戻るという事実はあまりにも有名ですが,生体外に取り出して,ばらばらにした肝細胞の増殖は依然として困難です.そこで,様々な細胞の利用が研究されてきました.ヒト肝ガン細胞や不死化細胞株は,正常肝細胞に比べて機能は格段に落ちますが無限増殖が可能であることから,高密度で増殖をさせればトータルの代替能を高めることができます.一方,ブタ肝細胞など異種であっても高機能を持つ正常肝細胞(生体から単離したばかりの初代培養細胞)の利用も盛んに検討されてきています.基本的な代謝や解毒の効果は期待できる一方で,ブタ肝細胞が作るタンパク質はブタ型であり,ヒトには効果がないこともあります.これらの欠点を解決するのがヒトiPS細胞等の幹細胞からの肝細胞への分化技術ですが,高価な増殖因子を必要とする分化誘導コストが課題です.
さて,最も有名なバイオ人工肝臓はUCLA・シダーズサイナイメディカルセンターのデミトリオ教授らのグループのものです(HepatAssist)2)(図2).ヒトでの初の臨床試験を行い,2004年の時点で既に85例の患者に適用されています.まず患者血液から血漿のみを分離し一旦リザーバータンクに溜めます.ここから,酸素富化装置や活性炭吸着カラムを経て,中空糸型のリアクターに正常なブタ肝細胞を固定化したバイオリアクターへと,患者血漿を高流量で灌流する仕組みです.主に肝移植待ちの患者の延命装置として,1日6-8時間の血漿灌流治療を複数回行うことで,移植まで橋渡しに成功しています.しかし,人工肝臓のみでの救命率の向上は非処置群に比べてわずかであるという結果となっています2).
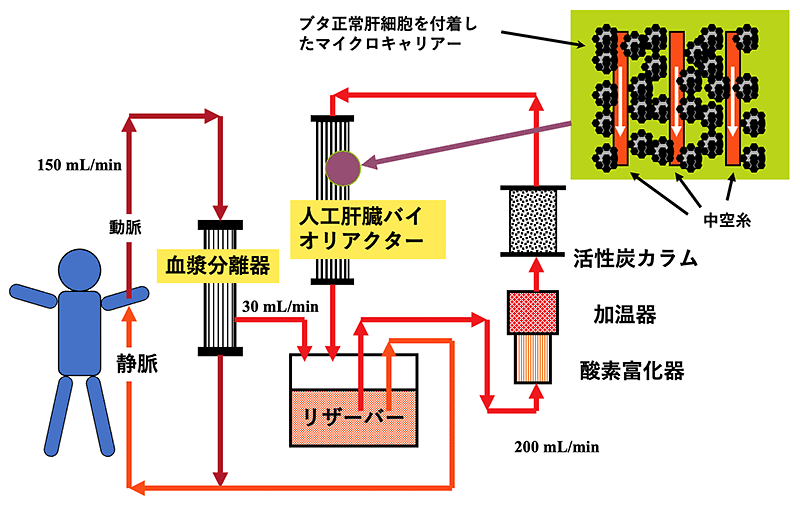
日本でもバイオ人工肝臓は盛んに研究されましたが,臨床に進むことはできていません.一方諸外国では,様々なシステムでの臨床試験の結果が報告されています.しかし,人工肝のみでの救命例は少なく,肝移植へ橋渡しをすることで最終的に救命を達成している例が大半です3).このことは,バイオ人工肝においても患者肝の再生の促進が大きな課題であることを浮き彫りにしています.物理的人工肝と比較すると,細胞調製やシステム構築維持の煩雑さも,医療としての普及を阻んでいます.
4.生体組織工学を利用した埋込型人工肝臓(再構築型肝組織,肝再生医療)
生体組織工学を利用した肝組織の構築―肝再生医療―は,ドナー不足を根本的に解消する手段として高い期待を集めています.肝移植を代替するためには当然患者肝と同規模の組織を構築する必要あり,未だ研究段階です.しかし,例えば遺伝性肝疾患などの治療ならば,少量の正常肝組織を移植すれば十分な効果が期待できるため,直近の目標とされています4).
肝臓は,小葉と呼ばれる直径1-2 mmの単位微小組織が並列に血液で灌流され,その中に毛細血管周囲に,薄いマトリックス・毛細血管壁を介して全て肝細胞が面するというように,血液との様々な物質のやり取りに適した構造をとっています(図3).このような構造を人工的に構築することは極めて困難ですが,少なくとも血液を介した酸素の供給に配慮して構造を設計・構築することが,細胞の生存性と高機能発揮のためには最も重要です.
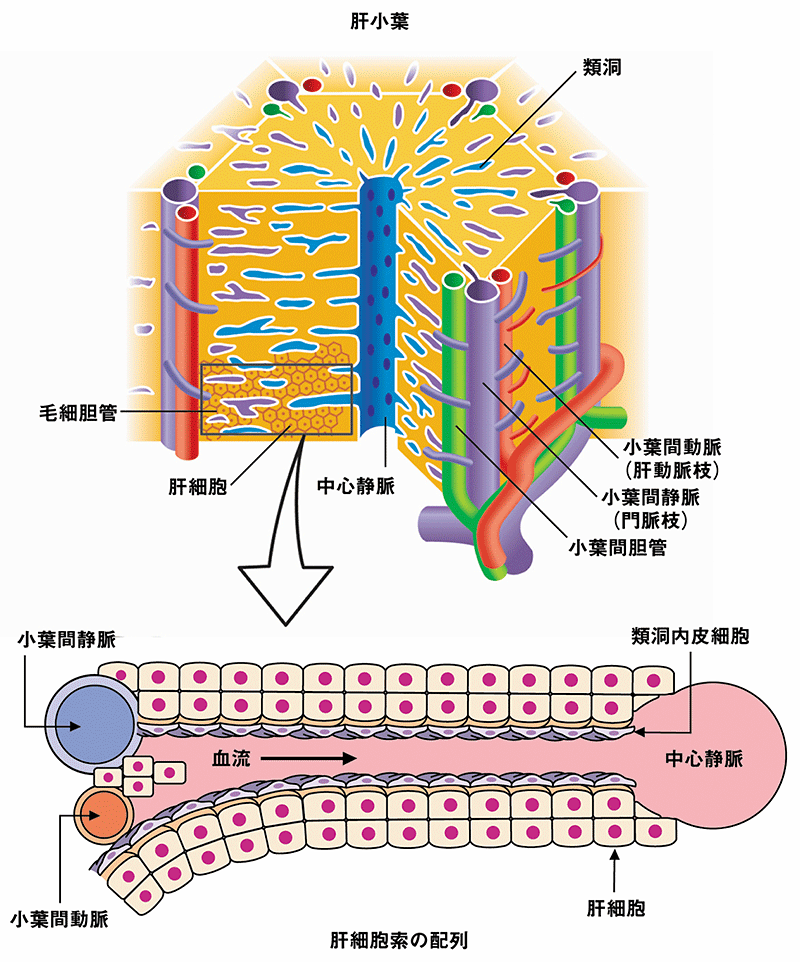
(人工臓器イラストレイティッド,日本人工臓器学会編(2007)より転載).
細胞への酸素供給からみると,生体肝では血液中は流れで,血管内壁から肝細胞へは主に濃度勾配による拡散に依っています.拡散で酸素供給が可能な組織の大きさは,組織中の酸素の拡散と消費のバランスから,厚み100μm程度の誌シート状や200μm程度の球状凝集体が限界です5).人体に移植できる細胞数には自ずと限界が生じますが,上述のような遺伝性肝疾患の治療には十分かもしれません.一方,多様な肝機能の大規模な置き換えのためには,血管の配備が必須となります.生体内のほとんどの細胞は最寄りの血管からいずれも200μm以内にあります.この限界は,血管から周囲組織への酸素拡散と消費のバランスとから計算されます.最終的な機能のフル発揮のためには,生体肝(図3)のように周囲のホスト組織からの血管新生が必要です.この前提として,生体外での構築・移植直後で細胞の良好な生存性を確保しておく必要があることは言うまでもありません(図4).
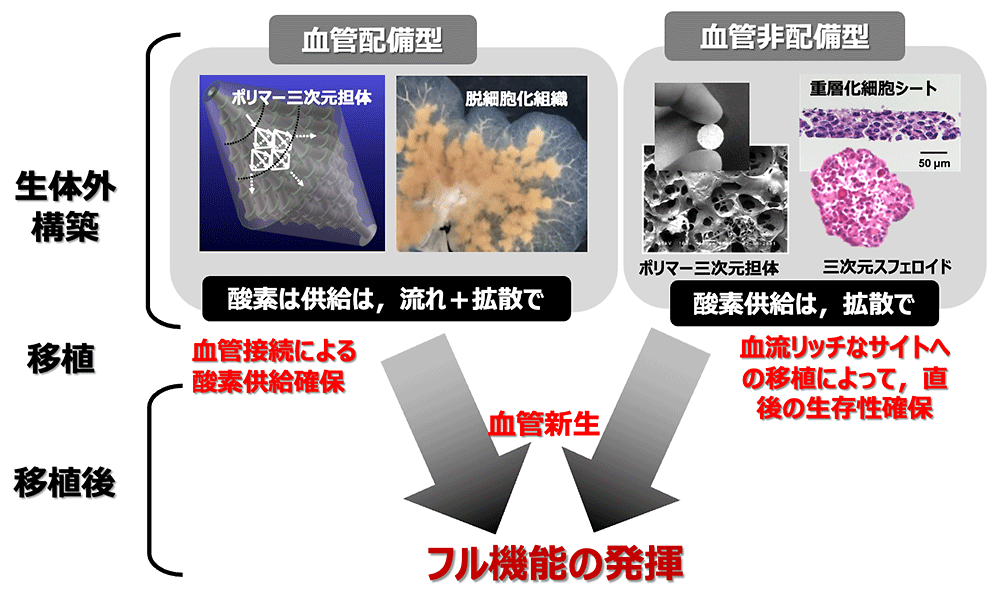
大型肝組織構築の前提となる血管配備について,毛細血管レベルの細かさは依然として困難ですが,それよりもやや太い血管系の配備は可能となっています.まず,人工的なポリマーを用いる手法としては,血管様構造を予め配備した生体吸収性ポリマーからなる担体に細胞を播種する手法,細胞をハイドロゲルと共に固体化しつつ内部に犠牲マテリアルを使用して三次元血管様流路を形成させる先進的なバイオファブリケーション法の2つが挙げられます.また,脱細胞化した動物臓器を三次元担体として用い,その中にヒト細胞を播種する手法で,界面活性剤で緩やかに灌流することで,細動脈・細静脈クラスまでの血管網を温存したマトリックスのみを残すこともできます.これに細胞を再播種すれば,移植に適した再構築型組織を作製することが可能です.最近,肝不全ブタの治療の成功が報告される6)など,現実的には最も有望と考えられます.これらの技術を今後,移植まで持ち込むためには,高細胞密度化・スケールアップに加えて,血管吻合を伴う患者への移植手技への適応,抗血栓性付与のための血管内皮細胞での内部流路の完全被覆,様々なタイムスケールでの免疫反応の回避などが課題となります.適切な動物モデルを用いた移植実験と生体外構築の試みのフィードバックによる改善がまだまだ必要です.
5.おわりに
体外循環型人工肝の救命率向上のキーは,物理化学的・生物学的の両方において,残された患者肝の再生の促進です.このためには,肝再生メカニズムの解明が強く求められます.研究開発は,より長期の機能代替を目指し,生体組織工学を利用した肝再生医療へと移りつつあります.一方,動物を利用したヒト型肝組織の構築も追究されています.近年,遺伝子改変ブタ由来の心臓や腎移植の臨床例が米国から多数報告されていますが,多様なヒト型の代謝機能が求められる肝臓では,例えば,完全なヒト肝の作成が可能な胚盤胞補完法に期待が集まります7).
文献
1) 阿部高弥,滝川康裕.人工臓器-最近の進歩人工臓器 2018; 47(3): 176-179.
2) Demetriou AA et al. Prospective, randomized, multicenter, controlled trial of a bioartificial liver in treating acute liver failure. Ann Surg 2004 239(5):660-7.
3) He Y et al., Bioartificial liver support systems for acute liver failure: A systemic review and meta-analysis of the clinical and preclinical literature, World J Gastroentorol, 2019, 25, 3634-2648.
4) 上野康晴,谷口英樹,iPS細胞由来の肝臓オルガノイドを用いた酵素補充療法の開発.Drug Delivery System 2020; 35(4): 278-284.
5) Sakai Y et al. Toward engineering of vascularized three-dimensional liver tissue equivalents possessing a clinically-significant mass. Biochem Eng J 2010; 48: 348-361.
6) Higashi H et al. Transplantation of bioengineered liver capable of extended function in a preclinical liver failure model, Am J Transplant 2022; 22: 731-744.
7) 長嶋比呂志, 松成ひとみ. 胚盤胞補完法による移植用臓器作製,医学のあゆみ 2020; 273(9): 820-825.
(東京大学大学院工学系研究科化学システム工学専攻 酒井康行)
このページの内容には万全を期しておりますがその内容を保証するものではありません。
このぺージは情報提供を目的としておりますが最終判断は自己責任でお願いします。
このページの内容によって生じたいかなる損害も日本人工臓器学会では負いかねます。