人工肺
1.人工肺とは
人工肺の「機能」と「使用目的」は下記になります。
機能:血液中に酸素を付加し、血液中から二酸化炭素を除去する「ガス交換」
使用目的①:心臓疾患を外科的に修復する手術(開心術)を行う際、心臓と肺への血液の流れを停止する必要があります。そこで、人工肺は、全身の代謝を維持するために、全身から心臓に戻る血液を体外に取り出し、血液ポンプにより人工肺を循環させることで、ガス交換を一時的に代行します。これは体外循環と呼ばれるものですが、通常、数時間程度の使用となります。
使用目的②:呼吸不全や心肺不全が発症し、人工呼吸器や内科的治療では十分な効果が得られない場合(生命を脅かすような重篤な状態)、呼吸機能や心機能を補助する必要があります。そこで、人工肺は、生命を維持するために、全身を循環する血液の一部を体外に取り出し、血液ポンプにより人工肺を循環させることで、ガス交換の一部を代行します。これは補助循環と呼ばれるものですが、一般的に「ECMO」と呼ばれています。この治療は、呼吸不全や心不全が改善するか、他の治療へ移行するまで継続され、数日から数週間の期間で使用されることになります。
2.生体肺のガス交換による酸素移動量(図1)
疫学調査などに用いられるメッツ(METs:Metabolic equivalents)とは、運動や身体活動の強度の単位ですが、安静時(静かに座っている状態)を1とした時と比較して何倍のエネルギーを消費するかで身体活動の強度を示します。呼吸により取り込まれた酸素は、各細胞に運ばれ、細胞呼吸により有機物を二酸化炭素と水に分解することにより、身体活動のエネルギーを作り出しています。このようにエネルギーの消費は酸素消費量に基づいており、1メッツが体重当り3.5mL/minの酸素消費量となります。例えば、80kgの体重の人では、1メッツで280mL/minの酸素消費量となり、呼吸による「酸素移動量」も同じとなります。
人は、肺を膨張、収縮させることにより、新鮮な空気を肺胞内に取り込み、空気と血液のガス交換を行いますが、これが外呼吸となります。安静時の呼吸量(分時換気量)は、1分間に行われる呼吸の回数(呼吸数)に1回の呼吸で肺に出入りする空気の量(1回換気量)をかけることで計算できます。80kgの体重の人の呼吸数を16回、1回換気量を460mLとすると、1分間に7360mLの空気が肺に取り込まれることになります。
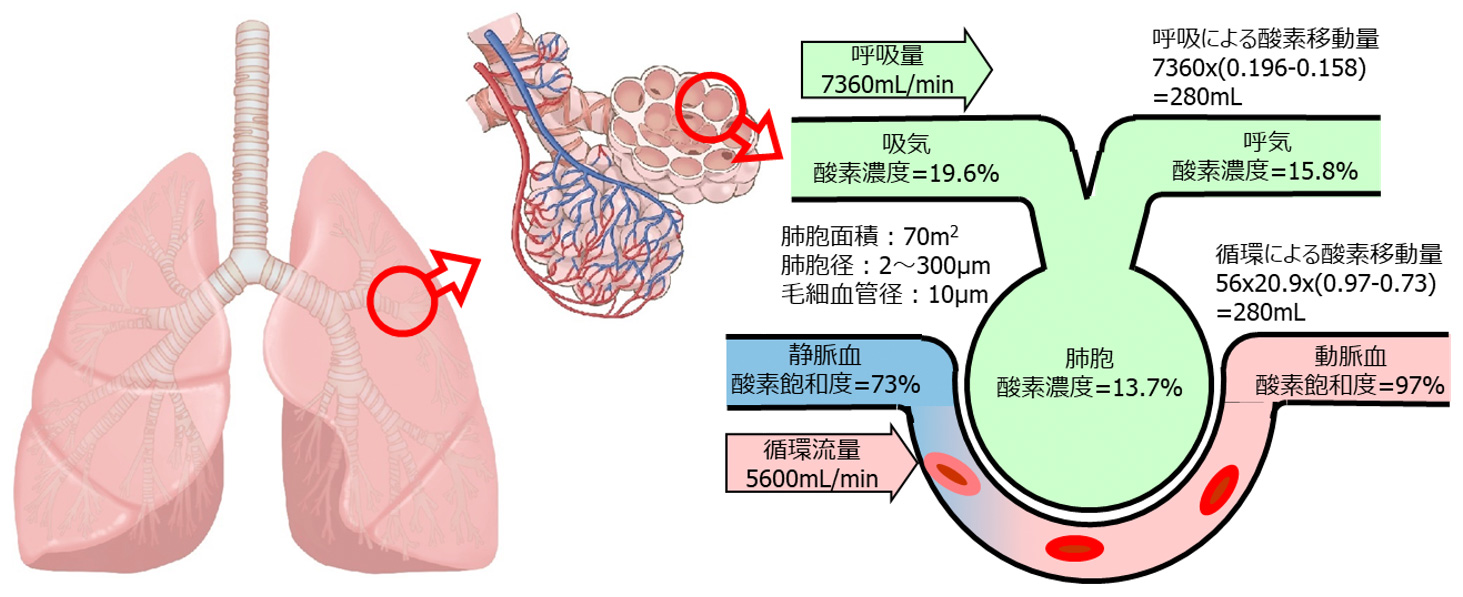
大気中の酸素濃度は20.9%ですが、吸い込まれた空気(吸気)は、加湿されることにより、酸素濃度が19.6%に低下します。この吸気が肺胞に到達すると、肺胞内に残存する空気と混合することにより、肺胞気の酸素濃度は13.7%に低下します。吐き出される空気(呼気)は、気道内に残った空気と混合することで、酸素濃度が15.8%に上昇します1)。ここで、吸気と呼気の酸素濃度の差(3.8%=19.6%-15.8%)に呼吸量(7360mL)をかけることにより、1分間での酸素移動量が280mL/minと計算できます。
左心室から大動脈に拍出された動脈血は、全身組織の毛細血管を通過し、各細胞に酸素を供給します。その後、静脈血となり、上下大静脈を経て右心房に戻ります。酸素濃度が低下した血液は、右心室より肺循環となり、肺胞を取り囲む毛細血管を通過し、ガス交換が行われます。
血液中の赤血球にはヘモグロビンと呼ばれるタンパク質が含まれ、このヘモグロビンが酸素と結合して、運搬の役割を担います。1gのヘモグロビンには1.39mLの酸素が結合できるとされています1)。血液中のヘモグロビン濃度を15g/dLとすると、1dLの血液中に最大の酸素結合量(酸素飽和度100%)は、20.9mLとなります。
安静時の静脈血の酸素飽和度は73%程度ですが、肺でのガス交換により動脈血の酸素飽和度は97%程度に上昇します1)。動脈血と静脈血の酸素飽和度の差(24%=97%-73%)に酸素結合量(20.9mL)をかけることにより、1dLの血液中の酸素の移動量は5.0mLになります。一方で、心拍数を70回/min、1回拍出量を80mL(体重当り1mLで、80kgの体重の人の場合)とすると、循環している血液の流量は5600mL/min(56dL/min)となります。ここで、血液の流量と血液中の酸素の移動量をかけることにより、1分間での酸素移動量が280mL/minと計算できます。
3.人工肺とECMOの歴史
1930年代には、動脈管開存症などの心臓周辺の手術が行われるようになっていましたが、心臓内の手術を行うには人工肺が必要であると認識されていました。よって、使用目的①である、開心術を行うための人工肺は、この当時に研究が開始され、1953年に、人工肺を用いた手術が世界で初めて成功しています2)。この手術に用いられた人工肺は、スクリーンフィルム型人工肺と呼ばれたもので、静脈血をステンレスの金網(スクリーン)の上でフィルム(薄膜)化し、その表面にガス(酸素)を吹き流すことにより、ガス交換を行うものでした。この手術では、先天性の心臓疾患である心房中隔欠損(左右の心房を隔てる壁に孔)の修復が行われ、人工肺により45分間のガス交換が行われました。
このフィルム型人工肺と並行して、他の種類の人工肺の検討も進められました。その一つが、気泡型人工肺と呼ばれるもので、血液中に気泡の形でガス(酸素)が直接導入され、気泡の表面でガス交換を行うものでした。気泡の大きさを制御することにより、ガス交換のための気泡表面積を大きくすることが可能になり、効率のよいガス交換が行えるものでした。血液中の気泡は、浮力で分離し、消泡剤(シリコンオイル)などによって取り除かれました。この人工肺は、プラスチック材料で製作でき、使い捨て可能となり、構造がシンプルであったことから広く普及しました。
フィルム型人工肺と気泡型人工肺は、血液とガスが直接接触するために効率の高いガス交換が行えましたが、血液への損傷が大きく、術後の合併症などにより長時間の循環には限界がありました。そこで、生体肺と同じように、膜を介したガス交換がより安全であり、長時間の循環が可能になるだろうと考えられ、膜型人工肺の研究が進みました。1970年代になり、シリコンゴムを材料にした膜型人工肺のいくつかが実用化されました。
膜型人工肺の登場により、体外循環によりガス交換が行える時間を長くすることが可能になりました。実際に、気泡型人工肺では3~4時間が限界であるとされていましたが、膜型人工肺により数日間のガス交換が可能になりました。このような中で、使用目的②であるECMOが行われるようになりました。ECMOとは、Extracorporeal Membrane Oxygenationの略語で、体外式膜型人工肺という意味ですが、膜型人工肺を用いる治療法の名称となりました。
世界で最初のECMOの成功例は、1972年に報告されたものとされています3)。交通事故により胸部大動脈の修復術を受けた患者が、術後に重度の急性呼吸不全を発症しました。従来の治療では改善しなかったために、ECMOが行われ、75時間の呼吸補助により改善されました。しかしながら、その後の呼吸不全に対する試験で、ECMOによる治療では、従来の治療と比較して十分な効果が得られなかったため、一般的には普及しませんでした。
2009年に新型インフルエンザが大流行しましたが、この際に、重症呼吸不全の救命療法として、ECMOが世界中で使用されました4)。1970年代のECMO装置と比較して、各構成品の技術的な進歩があり、疾患への理解も深まっていたことにより、高い治療成績が得られ、ECMO治療の有用性が再認識されました。このようなこともあり、2019年の新型コロナウイルスによる重症呼吸不全感染症に対しても、世界的な関心を集めることになりました5)。
一方で、使用目的②において、心肺不全が発症した際に、心機能を補助するためにECMOが使用されますが、この治療法は、1990年代に日本において、PCPS(percutaneous cardiopulmonary support:経皮的心肺補助法)とも呼ばれるようになりました。急性心筋梗塞などによるショック状態で、心肺蘇生の治療法として行われるようになりました。
4.膜型人工肺のガス交換膜(図2)
初期の膜型人工肺に用いられた膜は、高分子が隙間なく配置された均質膜と呼ばれるもので、この膜をガスが透過することによってガス交換が行われました。ガスの透過とは、ガスが膜に溶解して、拡散することを意味しますが、シリコンゴムは、他の高分子素材と比べて十倍以上のガス透過性能があることが報告されましたことで、人工肺に用いられるようになりました。ここで、拡散とは、膜の中でガスが散らばり、広がる物理的な現象のことですが、濃度の高いところから低いところに向かい、拡散量はその濃度差に比例します。
その後、高分子材料の技術的な進歩により、多孔質膜と呼ばれる材料が人工肺のガス交換膜に用いられるようになりました。この膜は、ガスは通過できるが、血液(水を主体とする血漿)は通過できない微細な孔を膜に複数設けたもので、ガスの移動が容易になります。現在、使用目的①である開心術で使用される人工肺には、この多孔質膜が使われています。膜の形態としては中空糸膜というもので、ストローのような中空で、内径が200μm、外径が300μm程度になっています。この膜の素材はポリプロピレンという高分子で、大きさが0.1~0.15μm程度の微細孔が複数設けられています。
使用目的②であるECMOで使用される人工肺は、複合膜または非対称膜と呼ばれる膜が使われています。先ほどの多孔質膜は、数時間の開心術においてはほとんど問題にならないのですが、数日から数週間の使用されるECMOにおいては、微細孔に血漿成分が浸入することによりガス交換性能が低下してしまいます。そこで、血漿の浸入を防ぐための検討が行われ、多孔質のポリプロピレン膜にシリコンをコートした複合膜と同じ素材で緻密層と多孔質層を有するポリメチルペンテンという素材でできた非対称膜が開発されました。これらの膜も中空糸膜の形態になっています。
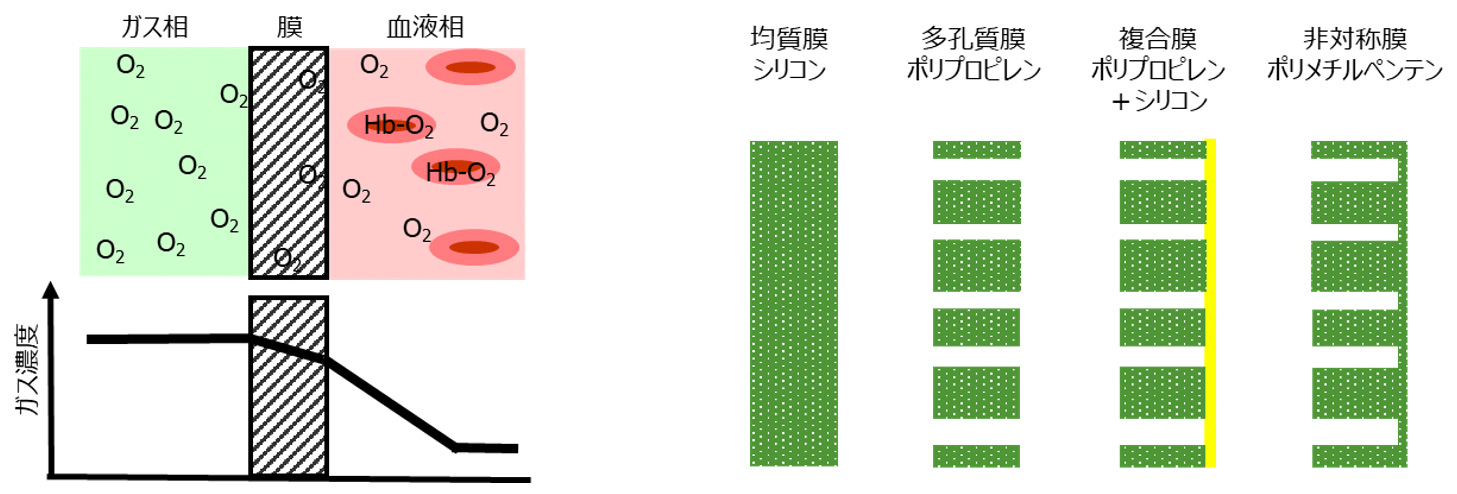
開心術やECMOで用いられるガス交換膜の有効膜面積は、成人用の人工肺で2~2.5m2になっています。成人の肺胞面積は70m2程度とされていますが、安静時には毛細血管の約1/3を通過した時点でガス交換され、人工肺と比べ、10倍程度の違いがあります。ガスの移動量は、膜面積と濃度勾配に比例しますので、人工肺は膜面積が少ない分を、酸素ガス濃度を高くすることにより必要な酸素移動量を確保しています。
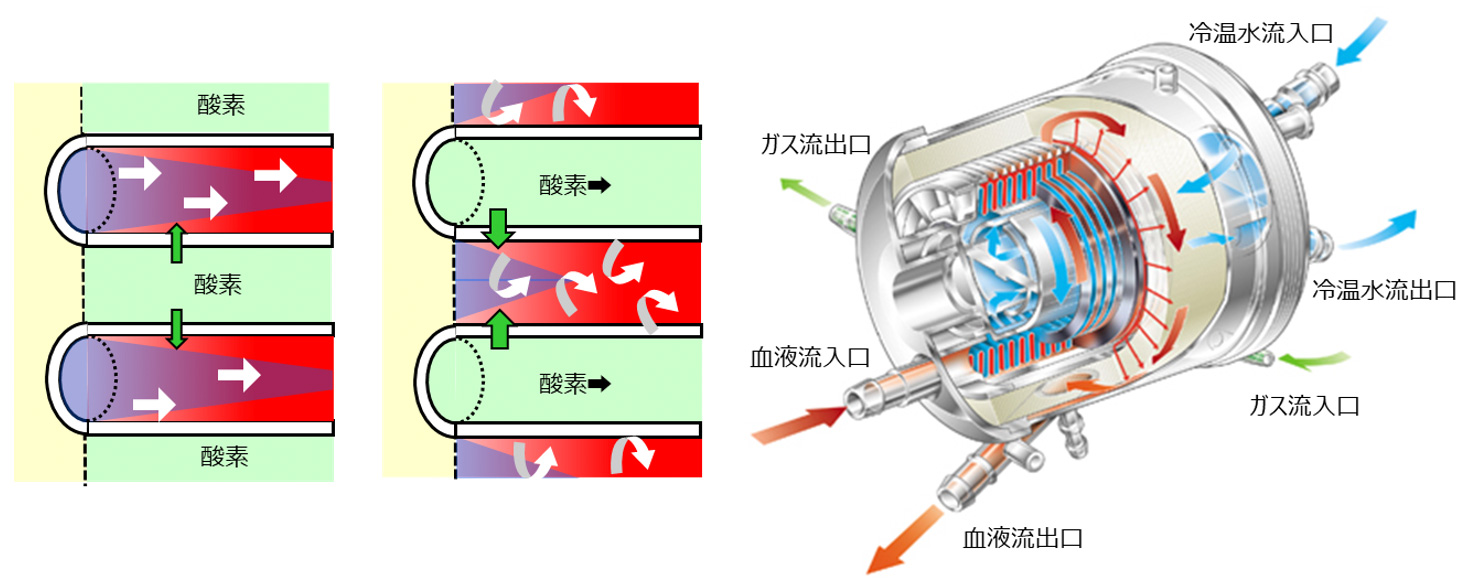
5.人工肺によるガス交換(図3)
生体肺の酸素移動量について前述しましたが、人工肺は、手術中の患者に必要な酸素移動量を確保する必要があります。一方で、医療機器を販売するには承認や認証が必要になりますが、人工肺の承認を受けるためには、厚生労働省で規定された「人工肺承認基準」に適合する必要があります。この承認基準において、人工肺のガス交換性能に関する規定があり、具体的には、「単位流量あたりガス移動量は、酸素にあっては45mL/min/L以上、二酸化炭素にあっては38mL/min/L以上であること」とされています。ここで、酸素移動量が45mL/min/Lの場合、前述の安静時の酸素移動量が280mL/minとするには、人工肺を流れる血液として、6.2L/minの流量が必要となります。
今日の人工肺に用いられているガス交換膜は、中空糸膜となりますが、初期の中空糸膜は血液が中空糸の内部を流れ、ガスの外部を流れるものでした。現在では、血液が中空糸の外部を流れるものになっていますが、血液が内部と外部を流れる場合の酸素移動について、それぞれのイメージを図に示しました。中空糸の内部を流れる血液は、一方向に流れるため(白の矢印)、静脈血(青)への酸素(緑)の移動は拡散により行われ、徐々に動脈血(赤)となっていきます。中空糸の外部を流れる血液は、流れる方向が一定でないために、攪拌効果が発生し、より酸素移動の速度は高まります。単純な比較はできませんが、過去に販売された内部式と外部式の人工肺を比較すると、同じ酸素移動量を得るために、膜面積に5~6倍の違いがありました。
中空糸の外部を血液が流れる人工肺の一例をイラストに示してあります。この人工肺は、円筒に中空糸膜をワインドさせながら巻き付けたもので、円筒の内部には血液の温度調整を行うステンレス製の熱交換器が設けられています。血液(赤の矢印)は、まずは血液流入口から熱交換器に流れ、温水/冷水(青の矢印)を流すことにより血液の温度が調整されます。その後、血液は巻き付けられた中空糸の外側を外周に向かって流れ、円筒の最外周でから血液流出口に向かいます。円筒の両端で切断された中空糸の内部をガス(緑の矢印)が流れることよりガス交換されます。この人工肺は、成人用のもので、ガス交換面積が2.5m2あります。血液流量が4L/minの時に、人工肺承認基準に基づく単位流量あたりの酸素ガス移動量は約70mL/min/Lで、約280mL/minの酸素量が移動できます。
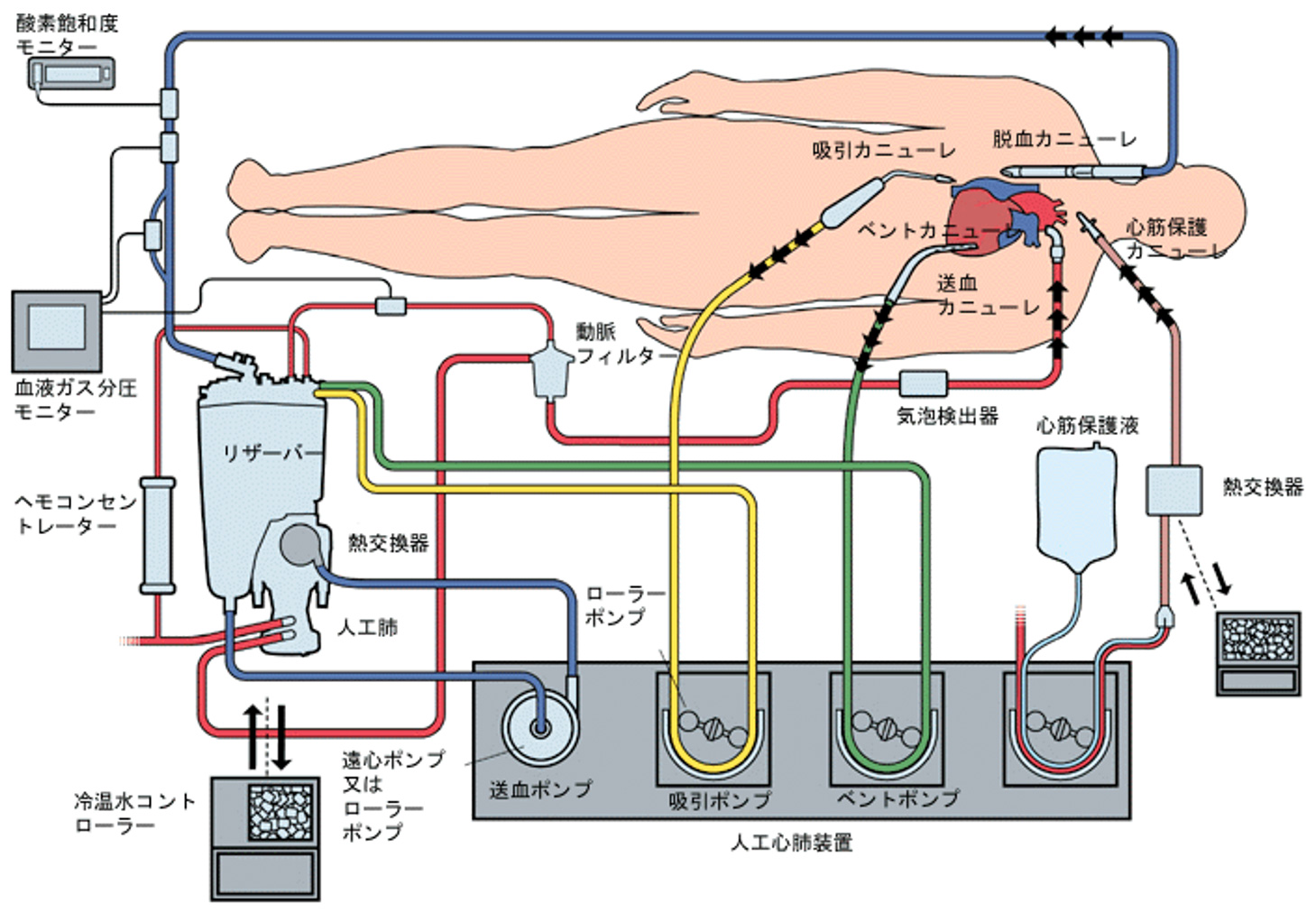
6.開心術における体外循環の構成(図4)
開心術における体外循環は、心臓と肺へ流れる血液を遮断するために行われます。従って、体外循環の主な血液の流れは、(1) 心臓に戻る静脈血を大静脈に挿入された脱血カニューレ(管)から取り出し、(2) リザーバー(血液を貯める槽)から血液ポンプにより送り出され、(3) 人工肺でガス交換し、(4) 大動脈に挿入された送血カニューレから動脈血として戻されます。これらが主な血液の流れの構成品になりますが、その他に血液の酸素濃度を測定するモニター、血液温度調整する熱交換器、血液中の異物取り除くための動脈フィルター、血液中の気泡を検出する装置なども組み込まれます。
主な血液の流れの他に、心臓を切開することにより出血した血液を回収するための吸引回路、心臓内の血液量を調整するベント回路、停止している心臓組織を保護するための回路などがあります。これらの体外循環回路の血液の流れるところにはあらかじめ液で充たしておく(プライミング)必要がありますが、プライミングの液量は約1000mL(成人の場合)になります。プライミング液には、血液などが使われることもありますが、主に代用血漿と呼ばれる薬剤が使われ、血液は希釈された状態で循環され、ガス交換されることになります。
このような人工肺を用いた心臓手術は、世界中で年間に100万件以上の症例で行われ、日本国内においても5万件以上の手術が行われています。このような心臓手術には、弁膜症、虚血性心疾患、先天性心疾患を治療するものであり、それぞれにより成績は異なりますが、全体としての手術死亡率は1%程度とされています。手術中における人工肺のトラブルとしては、機械的故障やガス交換性能の低下などがありますが、今日の人工肺では極めて低い発生率となっています。
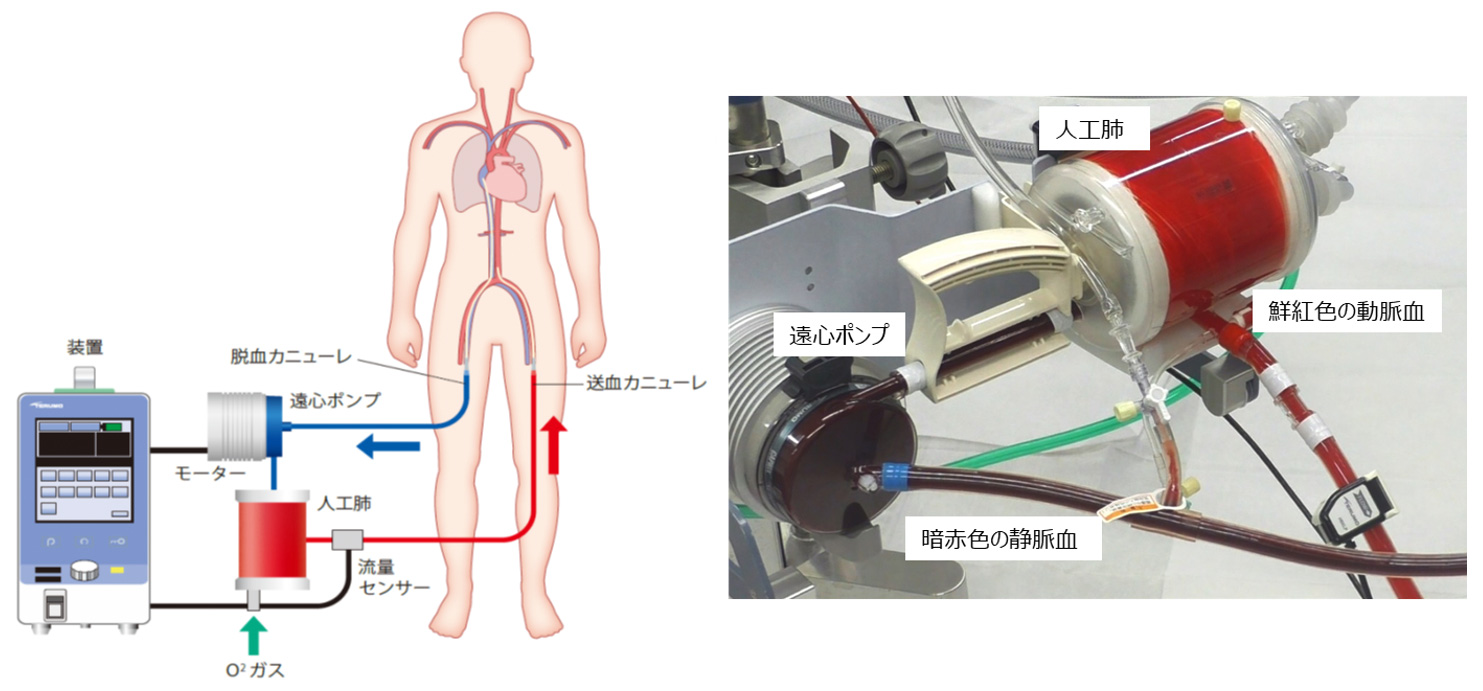
7.ECMOにおける補助循環の構成(図5)
ECMOの構成品は、開心術の主な血液の流れに用いられるものと同じになりますが、血液を貯めるためのリザーバーは一般的に用いられません。ECMOの主な血液の流れは、(1) 脱血カニューレから体外へ取り出し、(2)血液ポンプ(主に遠心ポンプ)により送り出され、(3) 人工肺でガス交換し、(4) 送血カニューレから体内に戻します。血液ポンプに遠心ポンプを用いる場合には、血液流量を測定するセンサーが必要になります。また、血液の酸素濃度など測定するモニターも用いられるようになっています。図にECMO回路に血液が流れている写真を示していますが、暗赤色の静脈血が、人工肺でガス交換され、鮮紅色の動脈血になっています。この色の変化は、ヘモグロビンに酸素が結合する割合が変わることにより発生します。
開心術とECMOの違いは、大きく二つあります。一つ目は、開心術では心臓への血液を遮断する必要があり、全身を循環する血液の殆どが体外に取り出される完全体外循環になりますが、ECMOの場合は、取り出される血液の割合が大きいですが、部分的な補助循環になります。二つ目は、血液を体内から取り出し、戻す血管(部位)が異なるという点です。開心術の場合は、心臓周辺の大きな血管(上下大静脈、大動脈)にカニューレが挿入されますが、ECMOの場合は、大腿動静脈(足の付け根)や頸静脈(首)が用いられます。さらに、ECMOにおいて、呼吸機能を補助する場合は、静脈から脱血して、静脈に送血しますが、心機能を補助する場合は、静脈から脱血して、動脈に送血します。つまり、生体の心臓と肺に対して、呼吸補助の場合は直列に、心補助の場合は並列にECMOが設置されます。
日本において、年間で1万件程度の症例がECMOで治療され、そのうち1割程度が呼吸補助に用いられているようです。ECMOは、生命を脅かすような重篤な状態に用いられます。呼吸補助としてECMOを用いる場合、人工呼吸器などの治療を継続しても80%の死亡率が予測される患者に使用され、ECMOの治療により死亡率が30~40%程度になっているようです6)。心補助としてECMOを用いる場合、心臓が停止した状態で、内科的治療に反応しない患者に使用されており、ECMO治療により生存率が20~30%程度になっているようです6)。ECMOにおける人工肺のトラブルの発生頻度は体外循環と比較して、高くなります。この要因として、血液が循環されている時間が長時間であること、重篤な状態の患者に用いられていることなどがあります。血液は異物に接触すると固まる(凝固)性質がありますが、このような治療中はヘパリン(抗凝固薬)などの薬剤を投与しながら行われますが、長時間になるとそのコントロールが困難になり、人工肺に血栓などが付着し、ガス交換性能が低下してしまいます。今後、このような課題を解決する人工肺の開発が望まれています。
(押山広明)
引用文献:
1) 榊原欣作 血液ガスの基礎知識(1)酸素について 日高圧医誌27:87‐98, 1992.
2) Gibbon JH Jr. Application of a mechanical heart and lung apparatus to cardiac surgery. Minnesota Medicine 37:171‐85,1954.
3) Hill JD, O’Brien TG, Murray JJ, Dontigny L, Bramson ML, Osborn JJ, Gerbode F. Prolonged extracorporeal oxygenation for acute post-traumatic respiratory failure (shock-lung syndrome). Use of the Bramson membrane lung. N Engl J Med 286:629-34,1972.
4) Zangrillo A, Biondi-Zoccai G, Landoni G, Frati G, Patroniti N, Pesenti A, Pappalardo F. Extracorporeal membrane oxygenation (ECMO) in patients with H1N1 influenza infection: a systematic review and meta-analysis including 8 studies and 266 patients receiving ECMO. Crit Care 17:R30,2013.
5) Barbaro RP, MacLaren G, Boonstra PS, Iwashyna TJ, Slutsky AS, Fan E, Bartlett RH, Tonna JE, Hyslop R, Fanning JJ, Rycus PT, Hyer SJ, Anders MM, Agerstrand CL, Hryniewicz K, Diaz R, Lorusso R, Combes A, Brodie D; Extracorporeal Life Support Organization. Extracorporeal membrane oxygenation support in COVID-19: an international cohort study of the Extracorporeal Life Support Organization registry. Lancet 396:1071-8,2020.
6) Squiers JJ, Lima B, DiMaio JM. Contemporary extracorporeal membrane oxygenation therapy in adults: Fundamental principles and systematic review of the evidence. J Thorac Cardiovasc Surg 152:20-32,2016.
このページの内容には万全を期しておりますがその内容を保証するものではありません。
このぺージは情報提供を目的としておりますが最終判断は自己責任でお願いします。
このページの内容によって生じたいかなる損害も日本人工臓器学会では負いかねます。